Les produits OTC aux Etats-Unis
Si en Europe la frontière entre les cosmétiques et les médicaments est assez claire, ce n’est pas le cas partout. Les Etats-Unis possèdent en effet un statut hybride, le produit OTC, qui répond à une réglementation particulière. Il est nécessaire de bien le connaître pour aborder le marché américain, afin de ne pas avoir de mauvaise surprise.

Qu'est-ce qu'un OTC ?
Le produit OTC, pour Over the counter, est un produit qui répond à la fois à la définition d’un produit cosmétique selon la réglementation américaine, mais également à celle d’un médicament (Figure). Il est considéré par la FDA (Food and Drug Administration) comme un médicament sans ordonnance, qu’il est possible d’acheter sans supervision d’un médecin (au comptoir, d’où son nom). Cela peut surprendre, mais plusieurs catégories de produits cosmétiques, considérés comme tels en Europe, tombent dans la catégorie des OTC aux Etats-Unis.
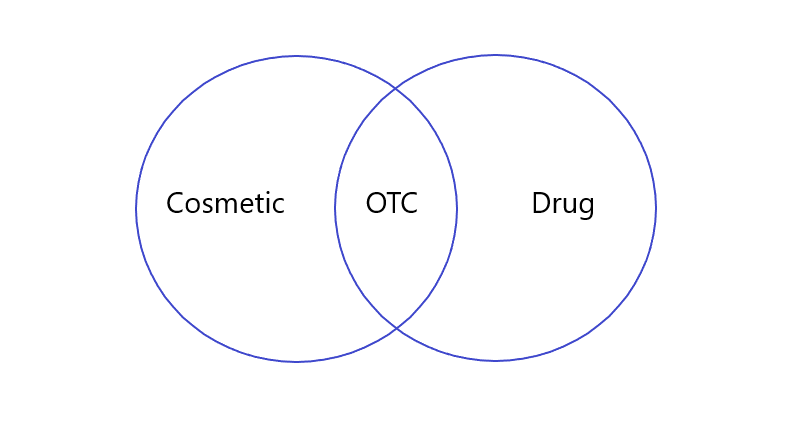
D’après la définition d’un cosmétique dans le Federal Food, Drug & Cosmetics (FD&C) Act, il s’applique sur le corps humain pour « pour nettoyer, embellir, rendre plus attirant ou modifier l’apparence ». Alors que les médicaments sont prévus pour « diagnostiquer, guérir, traiter ou prévenir l’apparition de maladies » ou « modifier la structure ou une quelconque fonction de l’organisme ». Mais comment un produit cosmétique bascule-t-il du côté d’un OTC ? C’est l’utilisation prévue (« intended use ») qui définit dans quelle catégorie il se trouve. En effet, si un produit possède plusieurs utilisations prévues, disons deux, et que l’une correspond à la définition d’un cosmétique, et l’autre à celle d’un médicament, le produit est un OTC ! L’exemple donné par la FDA est celui du shampoing antipelliculaire :
- L’une de ses fonctions est de laver les cheveux : c’est un produit cosmétique ;
- Son autre fonction est de lutter contre les pellicules : c’est un médicament.
On retrouve également dans ce cas de figure les produits solaires (prévention), les antitranspirants (modification d’une fonction de l’organisme), les produits contre l’acné ou encore les crèmes de soin avec un facteur de protection solaire.
L’utilisation prévue est définie par la FDA par plusieurs aspects :
– Les allégations : attention, aux Etats-Unis, toute communication autour du produit (incluant la publicité, un site internet, etc.) est concernée. Il est possible par exemple d’avoir un étiquetage conforme à la catégorie cosmétique pour une crème de soin, mais si une allégation « régénère la peau » (considérée comme une allégation thérapeutique) est présente dans une publicité ou autre, la FDA considère que le produit bascule dans la catégorie OTC. Il convient donc d’être vigilant sur toute forme de communication autour du produit ;
– La perception du consommateur, établie par la réputation du produit ;
– Les ingrédients spécifiques connus pour leur utilisation thérapeutique, comme le fluor dans les dentifrices.
Une fois qu’un produit est identifié comme OTC, les démarches adéquates sont nécessaires pour la mise sur le marché américain.
Comment mettre un OTC sur le marché américain ?
Les produits cosmétiques ne nécessitent ni enregistrement ni de validation par la FDA pour être mis sur le marché aux Etats-Unis (sauf s’ils contiennent des colorants, ou sur la base du volontariat). Pour les OTC, le metteur sur le marché doit prouver que son produit est « généralement reconnu sûr et efficace » (Generaly Recognized As Safe and Effective, GRASE). Il existe deux façons de procéder :
- Le produit rentre dans le cadre d’une monographie OTC : l’approbation de la FDA n’est pas nécessaire (encadré) ;
- Il n’existe pas de monographie OTC correspondant au produit : une demande de NDA (New Drug Application) à la FDA est nécessaire.
Dans le cas d’une demande de NDA, un dossier complet est nécessaire afin de prouver que les ingrédients, en particulier les substances actives, et le produit fini sont sûrs et efficaces. Ce dossier d’autorisation de mise sur le marché comporte tous les éléments permettant de le prouver, comme des essais cliniques. La FDA elle-même précise qu’un dossier de NDA doit « raconter toute l’histoire du produit ».
Qu’est-ce qu’une monographie d’OTC ?
En raison du nombre important de produits OTC mis sur le marché, la FDA a mis en place le système des monographies OTC, afin de gérer par catégories de produits, et non individuellement. Une monographie d’OTC est un peu comme un livre de recettes, qui précise les ingrédients autorisés, les concentrations, les formules et l’étiquetage adéquat (voir plus bas). Attention, pour éviter le passage par la case NDA, il convient de se conformer strictement à la monographie adéquate.
Quelle que soit la méthode choisie, un agent sur place (US agent) est nécessaire : personne physique ou entreprise, il est le lien avec la FDA et doit pouvoir répondre à ses questions, y compris sur les Bonnes Pratiques de Fabrication (BPF). En effet, la FDA exige pour les médicaments et les OTC la conformité aux BPF décrites dans le CFR (Code of Federal Regulations) parties 210 et 211 et réalise des audits.
La mise sur le marché d’un OTC requiert également les démarches suivantes auprès de la FDA (y compris lors de l’existence d’une monographie) :
- Une demande d’enregistrement d’établissement (établissement de fabrication, réemballage ou réétiquetage de produits pharmaceutiques à destination des Etats-Unis) ;
- Une demande de code d’étiquetage NDC (National Drug Code) ;
- L’enregistrement de la liste des produits OTC de chaque établissement.
Afin de ne pas risquer de sanctions de la FDA, une attention toute particulière est également portée à l’étiquetage des produits OTC.
Quelles obligations d'étiquetage des OTC aux Etats Unis ?
Les exigences d’étiquetage des produits OTC peuvent sembler proches de celles des produits cosmétiques aux Etats-Unis (mettre lien article étiquetage), mais elles présentent néanmoins quelques spécificités. L’étiquetage d’un produit OTC doit en effet respecter non seulement les obligations d’étiquetage des médicaments, mais également celles spécifiques aux produits OTC. Une des particularités de ces dernières est le tableau d’information du médicament (Photo) qui est présent sur le packaging secondaire (ou primaire s’il n’y a pas d’autre emballage), avec un format très codifié. Il doit comporter :
– L’intitulé « Drug facts » ;
– Une section « substances actives » avec leur quantité ;
– L’objectif du produit (purpose) ;
– Les indications du produit ;
– Les avertissements requis pour un OTC et ceux spécifiques à la monographie si applicable ;
– Les consignes d’utilisation ;
– Les « ingrédients inactifs », c’est-à-dire les ingrédients de la formule qui ne sont pas des substances actives ;
– Tout autre information nécessaire ;
– Un contact téléphonique en cas de questions sur le produit.
Si le produit OTC possède une monographie correspondante, des obligations d’étiquetage propres à chaque catégorie existent et sont précisées dans la monographie.

Conclusion
A la fois produit cosmétique et médicament pour la FDA, le produit OTC possède ses propres particularités réglementaires, qu’il convient de connaître avant d’envisager une mise sur le marché américain. Il n’est pas si difficile pour un produit considéré comme un cosmétique en Europe de basculer dans le statut beaucoup plus complexe d’un OTC aux Etats-Unis. C’est pourquoi une aide spécialisée est à considérer pour éviter les faux pas.
Plus ressources qui pourraient vous plaire